Contents
- 1 ワクチンにはどのような種類がありますか?【2/15追加!】
- 2 mRNAワクチンにはどのような成分が入っていますか?
- 3 mRNAワクチンにより人の遺伝子(染色体)に変化が生じてしまう可能性はありますか?
- 4 mRNAワクチンには遺伝子組換え技術が使われているのでしょうか。
- 5 ワクチンのmRNAは体内に残りますか?
- 6 どうしてワクチンがたった一年間でできたのか教えて下さい
- 7 mRNAワクチンの有効性について教えてください。
- 8 重症化を防ぐ効果について教えてください。
- 9 ワクチンは無症状の感染や感染伝播を防いでくれますか?ワクチンの接種によって他者への感染性(伝播性)は低くなりますか?
- 10 インフルエンザワクチンと比べて有効性、安全性はどうなのでしょうか?
- 11 ワクチンの効果は長期的に続きますか?
- 12 変異したウイルスにワクチンは効きますか?
- 13 mRNAワクチンの安全性や副反応について教えてください。
- 14 日本人における副反応の頻度について教えて下さい。【2/15追加!】
- 15 mRNAワクチンによって、1、2年後など長期的に生じる副反応の可能性はありますか?
- 16 mRNAワクチンによるアナフィラキシーについて詳しく教えて下さい。【2/15更新!】
- 17 接種後の副反応や安全性はどうやってモニターされますか?
- 18 新型コロナウイルスワクチンでADE(抗体依存性感染増強現象、Antibody-dependent enhancement)が起こりますか?
- 19 花粉症や食物アレルギーの既往があります。mRNAワクチンを接種して大丈夫ですか?【2/15更新!】
- 20 免疫不全やHIVの方にmRNAワクチンを接種しても大丈夫でしょうか?
- 21 担がん患者にも打って大丈夫でしょうか?
- 22 これから妊娠を考えている女性にmRNAワクチンを接種しても大丈夫でしょうか?
- 23 妊娠中の女性にmRNAワクチンを接種しても大丈夫でしょうか?
- 24 授乳中の女性にmRNAワクチンを接種しても大丈夫でしょうか?
- 25 子供にも接種すべきでしょうか?
- 26 新型コロナウイルスに感染した場合(既感染の場合)も接種が必要ですか?
- 27 二回接種ではなく、一回接種だけで効果ありますか?
- 28 一回目と二回目で違うmRNAワクチンを接種しても大丈夫ですか?
- 29 ワクチン接種後に感染予防策は不要ですか?
- 30 インフルエンザワクチンや帯状疱疹ワクチンなど、他の予防接種を新型コロナウイルスのワクチンの前後にうけても大丈夫ですか?
- 31 お金はかかりますか?
- 32 作成
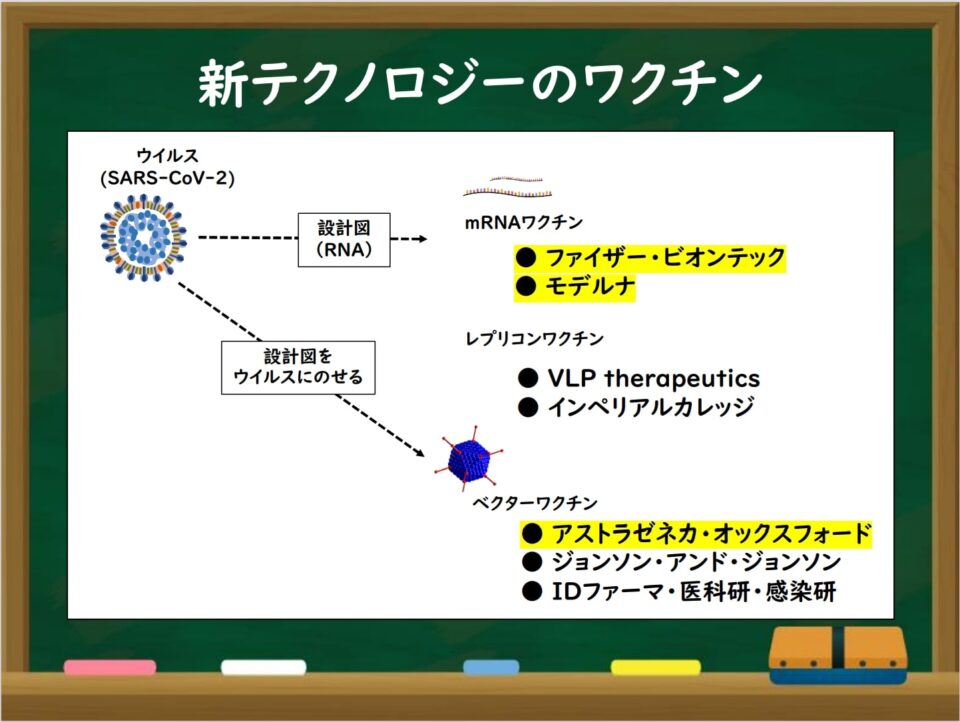
ワクチンにはどのような種類がありますか?【2/15追加!】
ウイルスや細菌などの病原体そのものや、病原体を構成する物質などをもとに作ったワクチンを接種することで、その病原体に対する免疫ができます。
ワクチンの種類は具体的には、以下のようなものがあります。
・生ワクチン
病原性を弱めた病原体からできています。
接種すると、その病気に自然にかかった場合とほぼ同じように免疫がつくことが期待できます。
・不活化ワクチン、組換えタンパクワクチン
感染力をなくした(不活化という)病原体や、病原体を構成するタンパク質からできています。
・mRNAワクチン、ベクターワクチン、DNAワクチン
これらのワクチンでは、ウイルスを構成する一部のタンパク質の遺伝情報(設計図)の書き込まれた核酸や、核酸をのせたベクター(運び屋)を投与します。
その遺伝情報をもとに、体内でウイルス由来のタンパク質がつくられ、さらに、そのタンパク質に対する抗体が作られることで免疫を獲得します。
*ベクター:ワクチンに必要な核酸情報などを人の細胞に運ぶために、運搬役として使われるヒトに対して病原性のないウィルスなどのこと。(例:病原性のないアデノウィルス)
新型コロナウイルスワクチンには以下のものがあります
mRNAワクチン: ファイザー・ビオンテック社ワクチン、モデルナ社ワクチン
ベクターワクチン: オックスフォード・アストラゼネカ社ワクチン、ジョンソン・エンド・ジョンソン(ヤンセンファーマ社)ワクチン(米国で緊急下使用許可が検討される予定)等
組換えタンパクワクチン: ノババックス社ワクチン(第三相臨床試験が終了)
mRNAワクチンにはどのような成分が入っていますか?
新型コロナウイルスのmRNAワクチンの成分は、ファイザー・ビオンテック社製、モデルナ社製いずれも次の3つのカテゴリーの成分からなっています。
1. mRNA本体
2. 脂質(lipid)… ポリエチレングリコール(PEG)を含む運搬体
3. 塩類とショ糖と緩衝剤
これらの成分はいずれもヒトへの投与経験があるものです。
いずれのワクチンにもアジュバント・(水銀を含む)保存剤は含まれていません。
また、無細胞系で合成されているため、細胞の成分等が混入することも原理的にあり得ません。
詳細は以下のFDA資料
2. モデルナ社ワクチン
mRNAワクチンにより人の遺伝子(染色体)に変化が生じてしまう可能性はありますか?
ワクチンのmRNAは人の核に入り込むことはほぼなく、核に入ったとしてもワクチンには含まれていない逆転写酵素がないとDNAに変換されることもありません1)。
また、インテグラーゼという酵素も存在しないためDNAに組込まれることもできません。
つまり、染色体に影響をあたえることで人の遺伝子に変化を起こすことはありません。
- IDSA. Vaccines FAQ
mRNAワクチンには遺伝子組換え技術が使われているのでしょうか。
mRNAワクチンには遺伝子組換えの技術は使われていません。RNAはヒトの細胞の核に入ることはほぼなく、リボソームに読み込まれた後、細胞内の酵素で速やかに分解されます。安全性は大規模な臨床試験で確認されています1,2)。
- CDC. Ensuring the Safety of COVID_19 Vaccines in the United States
- 一般社団法人日本感染症学会ワクチン委員会.COVID-19 ワクチンに関する提言 (第 1 版)
ワクチンのmRNAは体内に残りますか?
mRNAはヒトの細胞内でリボソームに読み込まれた後は、速やかに細胞内酵素により分解されますので体内には残りません。
- IDSA. Vaccines FAQ
どうしてワクチンがたった一年間でできたのか教えて下さい
ファイザー・ビオンテック社及びモデルナ社のワクチンの緊急使用許可(EUA)が、開発から1年以内で行われたことに不安を覚える方も多くいると思います。
今回のワクチンの開発から承認がこれほど早く進んだ理由はいくつかあります1-3)。
・2002-2003年に流行した重症急性呼吸器症候群(SARS)とその原因であるウイルスのスパイク蛋白質(今回の新型コロナウイルスに類似)に関する研究の蓄積
・遺伝解析技術の向上や、mRNAワクチンに関する長年の研究の蓄積により、遺伝子配列が公開されればすぐにワクチンをデザインできる技術が開発されていたこと
・いくつかの段階の動物実験や臨床試験を同時並行で行ったこと
・ 感染流行により大規模な臨床試験の進みが早かったこと
・米国政府による大量の資金の投入
・最終的な臨床試験を終える前から承認審査を始め、結果がわかればすぐに承認する準備ができていたこと
など、様々な要因が挙げられています。
一方で、開発されたmRNAワクチンはいずれも、米国の審査で評価された臨床試験(ファイザー・ビオンテック社は43,448人、モデルナ社は30,420人)は申し分ない規模のものです4,5)。また、FDAの承認審査はYouTubeで生配信されるなど、有効性や安全性については従来のワクチンよりも透明性の高い方法で検証されています。
- Nature. 2021;589:16-18
- N Engl J Med. 2020;382:1969-73
- Moderna. Moderna Announces Progress in Prophylactic Vaccines Modality with CMV Vaccine Phase 2 Study Data Now Expected in Third Quarter 2020 and Expands Investment in This Core Modality with Three New Development Candidates https://investors.modernatx.com/news-releases/news-release-details/moderna-announces-progress-prophylactic-vaccines-modality-cmv
- N Engl J Med. 2020;383:2603-15
- N Engl J Med. 2021;384:403-16
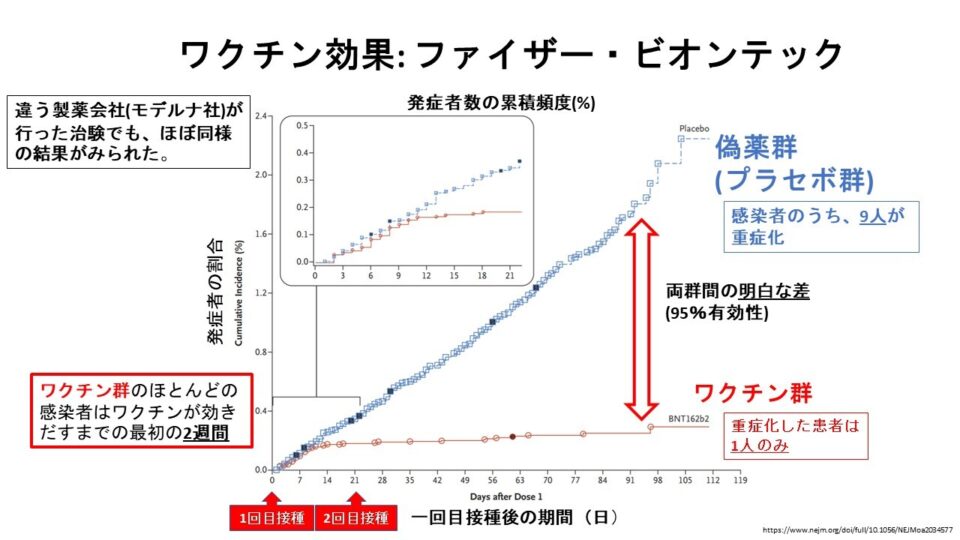
mRNAワクチンの有効性について教えてください。
日本で承認作業が進められているファイザー・ビオンテック社ワクチン(BNT162b2)の第2/3相試験1)とモデルナ社ワクチン(mRNA-1273)の第3相試験2)において、COVIDの発症に対する有効性は、約95%と非常に高いことがわかっています(図参照)。
これはワクチンを接種しなかった群(プラセボ群)と比べ、接種した群の方が発症者の割合が95%少なかったということです(リスク比)。
- N Engl J Med. 2020;383:2603-261
- N Engl J Med 2021;384:403-416
重症化を防ぐ効果について教えてください。
ファイザー・ビオンテック社ワクチンでは89%(ワクチン vs. プラセボ, 1人 vs. 9人, 有効性88.9% [95% CI, 20.1 – 99.7%])、モデルナ社ワクチンでは100%(ワクチン vs. プラセボ, 0人 vs. 30人, 有効性100% [95% CI推定不能])の重症化予防効果が示されています1,2)。ファイザー・ビオンテック社の大規模臨床試験におけるワクチン群での重症例は、酸素飽和度93%であったため臨床試験における重症の定義を満たしていたものの、入院も必要としなかったことが報告されています3)。
ファイザー・ビオンテック社ワクチンの重症の定義(以下の1つを満たす)
-
-
- 安静時の重い全身症状(呼吸数 ≥30回/分, 脈拍 ≥125/分, SpO2 ≤93%、もしくはPaO2/FiO2 <300 mm Hg)
- 呼吸不全
- ショックの証拠
- 重症の腎障害、肝障害、神経障害
- ICUへの入室
- 死亡
-
モデルナ社ワクチンの重症の定義(以下の1つを満たす)
-
-
- 呼吸数30回/分以上
- 脈拍125bpm以上
- 室内気でSpO2 93%以下
- 呼吸不全
- ARDS
- ショックの証拠(収縮期血圧<90mmHg、拡張期血圧<60mmHg、昇圧剤が必要)
- 臨床的に重要な腎障害、肝障害、神経障害
- ICUへの入室
- 死亡
-
- N Engl J Med. 2020;383:2603-261
- N Engl J Med 2021;384:403-416
- FDA. Vaccines and Related Biological Products Advisory Committee Meeting December 10, 2020 https://www.fda.gov/media/144245/download
ワクチンは無症状の感染や感染伝播を防いでくれますか?ワクチンの接種によって他者への感染性(伝播性)は低くなりますか?
臨床試験では、mRNAワクチンが新型コロナウイルス感染症の発症と重症化を防いでくれるということが証明されています。
無症状の感染や他者への感染伝播の予防や予防の程度は、現在調査中であり、十分な量のデータがまだ出そろっていません1)。
モデルナ社ワクチンの第3相試験では一回目と二回目の接種時にPCR検査を実施しており、二回目の接種時に無症状でPCRが陽性だった人の数がワクチン群の方が少なかった(ワクチン群14人 [0.1%] vs. プラセボ群38人 [0.3%])ことが分かっています2)。
無症状の感染も防いでくれることが期待されます。
- IDSA. Vaccines FAQ
- FDA. mRNA-1273 Sponsor Briefing Document Addendum Vaccines and Related Biological Products Advisory Committee Meeting Date: 17 December 2020
インフルエンザワクチンと比べて有効性、安全性はどうなのでしょうか?
インフルエンザワクチンの有効性は年によって異なりますが、概ね40-60%程度であり1)、mRNAワクチンはこれよりも高い有効性があると考えられます2,3)。
ファイザー・ビオンテック社ワクチン、モデルナ社ワクチンは、他のワクチンと同様の臨床試験を経ており、安全性が適切に確認されています。
第3相にあたる試験においては、通常は数千人規模で安全性や効果を確認するところ、3-4万人の規模で行われました。
今後接種人数が増え、数万人規模の臨床試験では検出されなかった副反応や、長期の時間が経ってから分かる副反応が出てくる可能性はゼロではありませんが、非常に稀と考えられます。
- CDC. Seasonal Flu Vaccine Effectiveness Studies
- N Engl J Med. 2020;383:2603-15
- N Engl J Med. 2021; 384:403-416
ワクチンの効果は長期的に続きますか?
新しいワクチンであり、治験が開始されてから時間が経過してないため、まだどのくらいの期間免疫が持続するのかは分かっていません。
モデルナ社ワクチンの第1相試験のデータからは少なくとも4か月は十分な量の中和抗体が維持されることが分かっています1)。
- N Engl J Med. 2020;383:1920-1931
変異したウイルスにワクチンは効きますか?
変異ウイルスの報告が続いており、引き続きサーベイランスとワクチン効果の検証が必要です。
いくつかの研究ではmRNAワクチン投与後の血清による中和能の低下などが報告されていますが、中和能が極端に損なわれるものは今のところなく、ある程度は効果があるのではないかと考えられています1-3)。
もし今後、現在のワクチンが効かない変異が出現しても、mRNAワクチンであれば効果的なワクチンを迅速につくることが出来るもので、実際にモデルナ社は南アフリカで見つかった変異に対応したワクチンを既に制作しています。
- bioRxiv. mRNA-1273 vaccine induces neutralizing antibodies against spike mutants from global SARS-CoV-2 variants.external icon
- bioRxiv. Neutralization of N501Y mutant SARS-CoV-2 by BNT162b2 vaccine-elicited seraexternal icon
- bioRxiv. Comprehensive mapping of mutations to the SARS-CoV-2 receptor-binding domain that affect recognition by polyclonal human serum antibodiesexternal icon
mRNAワクチンの安全性や副反応について教えてください。
ファイザー・ビオンテック社ワクチンでは、接種部位の腫れや痛み8割、頭痛5割、悪寒4割、発熱は約15%の被験者で認められました1)。
モデルナ社ワクチンも同じような結果で、接種部位の痛みや腫れは9割、頭痛6割、悪寒4割、発熱17%程度でした2)。
ファイザー・ビオンテック社ワクチンもモデルナ社ワクチンも、接種に付随して生じる腕の痛みや発熱等の(免疫)反応原性が高いワクチンであることは分かっています3-5)。
これらの反応は自分の免疫が応答している過程で生じますが、ほとんどは2-3日でよくなります。
症状が出て辛いようであれば解熱鎮痛薬を使用することができます。
これらの反応は一般的に、1回目よりも2回目の接種で起こりやすく、高齢者よりも若年者で多く報告されています。
翌日が休みの日にワクチン接種を予約するなどして、二回目の接種後に休めるよう組む事が推奨されます。
もし反応が起こっても、ワクチンではスパイクタンパク質というウイルスの一部分しか作られないので、新型コロナウイルスに感染することはありません。
- N Engl J Med. 2020;383:2603-261
- N Engl J Med 2021;384:403-416
- CDC. Ensuring the Safety of COVID_19 Vaccines in the United States
- FDA. Vaccines and Related Biological Products Advisory Committee Meeting December 10, 2020 FDA Briefing Document Pfizer-BioNTech COVID-19 Vaccine
- FDA. Vaccines and Related Biological Products Advisory Committee Meeting December 17, 2020 FDA Briefing Document Moderna COVID-19 Vaccine
日本人における副反応の頻度について教えて下さい。【2/15追加!】
2021年2月14日に特例承認されたファイザー社ワクチン「コミナティ」の添付文書によりますと、日本人160例(本剤接種群:119例、プラセボ接種群:41例)を対象に調査が行われ、2回目の接種後の注射部位の疼痛は79%、疲労60%、筋肉痛16%、発熱33%とのことで、ほとんどは内服薬で改善し日常生活に支障をきたさない程度(Grade 2)まででした。

mRNAワクチンによって、1、2年後など長期的に生じる副反応の可能性はありますか?
ワクチンの副反応のほとんどは、比較的短期的、投与して6週間以内に起こることが分かっています1)。
そういうこともあり、FDAは新型コロナウイルスに対するワクチンの承認条件として、投与されたあとのフォローアップの期間の中央値が2ヶ月間あることを条件としました2)。
ワクチンの副反応として重要なものは、免疫による副反応です。
mRNAがDNAに組み込まれないこと、mRNAが比較的短期間で分解されることを考えると、長期的に起こってくる副反応の可能性はゼロではありませんが、非常に稀と考えられます。
臨床試験は現在も継続中で、長期的な副反応についても評価がされています。
- National Childhood Vaccine Injury Act: Vaccine Injury Table
- Emergency Use Authorization Overview and Considerations for COVID-19 Vaccines
mRNAワクチンによるアナフィラキシーについて詳しく教えて下さい。【2/15更新!】
新型コロナウイルスのmRNAワクチンでも、非常に稀ですがアナフィラキシーの報告が出ています。
2021年2月12日に発表されたのJAMAの論文によると、ファイザー・ビオンテック社ワクチンでは 100万投与で4.7例、モデルナ社ワクチンでは2.5例のアナフィラキシーが起こったとのことです1)。
いずれの方にも適切な初期対応が行われ、回復しています。
インフルエンザワクチンでのアナフィラキシーの頻度は100万人に1人程度とされており、それよりは頻度は多いですが、非常に稀であることは変わりません。
アナフィラキシーに対しては治療薬であるアドレナリン(エピネフリン)が有効です。
接種会場では接種後、アレルギー反応が起きないかの経過観察時間が設けられ、万が一アナフィラキシーが起こった場合、速やかにアドレナリンを投与し、処置・診療を受けられる体制が整備されます。
- JAMA. 2021. doi:10.1001/jama.2021.1967
接種後の副反応や安全性はどうやってモニターされますか?
アメリカではV safe, Vaccine Adverse Event Reporting System (VAERS), Vaccine Safety Datalink, Clinical Immunization Safety Assessment (CISA), Biologics Effectiveness and Safety System (BEST) やその他のネットワークなど、多くの情報をもとに安全性を確認・評価するシステムが複数存在します1)。
日本でも副反応情報を収集・モニターする仕組みができることとなっています。
また、接種後に予期せぬ有害事象・副反応疑いの症状が出た場合、予防接種法により医師等が報告をする義務があります2)。
新型コロナウイルスワクチンでADE(抗体依存性感染増強現象、Antibody-dependent enhancement)が起こりますか?
ADEは、感染やワクチンによって作られた中和能のない抗体が、ウイルスが人の細胞に入りこむのを助け、ウイルスの感染を悪化させてしまう現象です。
これはデング熱ワクチン等で報告されました1)。
また免疫複合体等が気道で強い炎症を引き起こすこともあります(ワクチン関連増強呼吸器疾患 Vaccine-associated enhanced respiratory disease VAERDといいます)。
ワクチン開発では、ADEやVAERDが起こらないように高い中和能がある抗体を作らせ、そしてTh1細胞優位の免疫反応を誘導するワクチンの開発が大切です。
ファイービオンテック社ワクチン、モデルナ社ワクチン、オックスフォードアストラゼネカ社ワクチン全て、高い中和作用を持つことが分かっています。
またTh1優位の免疫が誘導されることが分かっています。また第2/3相臨床試験ではADEを起こした被験者はいませんでした2-3)。
重症患者も殆どがワクチン群ではなくプラセボ群でした。
VAERDはmRNAワクチン接種後の動物実験でも起こっていません4-5)。
以上より、新型コロナウイルスワクチンにおいてADEが懸念されることは現状ではとても考えにくいと言えます。
- N Engl J Med 2018;379:327-40
- N Engl J Med. 2020;383:2603-261
- N Engl J Med 2021;384:403-416
- N Engl J Med 2020;383:1544-1555
- bioRxiv. A prefusion SARS-CoV-2 spike RNA vaccine is highly immunogenic and prevents lung infection in non-human primates https://doi.org/10.1101/2020.09.08.280818
花粉症や食物アレルギーの既往があります。mRNAワクチンを接種して大丈夫ですか?【2/15更新!】
米国のCDCはワクチンや注射薬以外の物(食べ物、動物、ラテックス等)に対する重症なアレルギー反応の既往がある方も接種可能としています1)。
経口薬やアナフィラキシーの家族歴がある方への接種も可能です。
米国CDCによると、ワクチンの成分に対する重篤なアレルギー反応の既往がある方への接種は禁忌です1)。
アナフィラキシーの原因として最も疑われているのはポリエチレングリコール(PEG)という物質です。
PEGにはたくさんの種類があり、大腸検査の下剤や薬剤、日用品等に幅広く使われています。
米国CDCはPEGやポリソルベートに対するアレルギーの既往がある方も接種を控える事を推奨しています。
また、mRNAワクチンの第一回目の接種直後にアレルギー反応が出た方は二回目の接種を控えるよう推奨しています。(上記はCDCによる2021年2月15日時点における推奨事項です)

免疫不全やHIVの方にmRNAワクチンを接種しても大丈夫でしょうか?
HIV感染者であっても、コントロールが良好な方は治験対象に含まれていました1)。
しかし、免疫不全やHIVに感染している方に対するワクチンの有効性や安全性は、まだ十分明らかになってはいません。
これらの基礎疾患のある患者については新型コロナウイルスの感染で重症化するリスクが高い可能性があります1)。
個々の患者におけるリスクとベネフィットを十分説明した上で、接種を検討して頂く必要があります2)。
- CDC. Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States
- 日本リウマチ学会.新型コロナウイルス(COVID-19)ワクチンについて
担がん患者にも打って大丈夫でしょうか?
担がん患者におけるmRNAワクチンの有効性や安全性に関するデータは限定的です1,2)。
生ワクチンではないため、基本的には他のワクチンと同様の扱いでよいと考えられます。
抗がん剤の治療の影響で、ワクチンによる免疫応答(B細胞やT細胞の応答、B細胞による抗体産生能)が不完全となる可能性があります。
そのため、接種後も感染対策を徹底し続ける必要があります。
一般的に、癌患者がワクチンを受けられなかったり、その有効性がはっきりしない場合、周りの家族がワクチンを接種して感染を防ぐことにより、重症化リスクの高い癌患者・高齢者・免疫抑制患者への感染を防ぐ効果があるとされています。
mRNAワクチンに同様の効果があるかはまだ分かっていませんが、その効果が強く期待されます。
- CDC. Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States
- IDSA. Vaccines FAQ
これから妊娠を考えている女性にmRNAワクチンを接種しても大丈夫でしょうか?
米国のCDCは、mRNAワクチン接種の前に妊娠検査を行うことや、ワクチンのために妊娠を遅らせる必要はないとしています1)。
米国家庭医療学会は、mRNAワクチンは不妊とは関連がないとしています。
- CDC. Vaccination Considerations for People who are Pregnant or Breastfeeding
- American Academy of Family Physicians. COVID-19 VACCINE FAQ
妊娠中の女性にmRNAワクチンを接種しても大丈夫でしょうか?
妊婦中の女性に対するmRNAワクチンの安全性や有効性は十分評価されていませんが、米国などでは希望者は接種が可能です1)。
米国CDCとACIPは、妊婦で感染のリスクが高いグループに所属する方(医療従事者等)に接種の機会が与えられるべきだとしています。
WHOも、リスクの高いグループに属する妊婦へのワクチン接種を考慮してよいとしています2)。
妊婦は妊娠していない同世代の女性と比較し、新型コロナウイルスに感染した場合重症化しやすく、また早産等のリスクが上がることが主な理由です。
接種を行う場合には、発熱等の副反応が起こり得ることも十分な説明を行うことが大切です。
日本で妊婦がワクチンの接種対象になるかは明らかではありませんが、日本産婦人科感染症学会は「流⾏拡⼤の現状を踏まえて、妊婦をワクチン接種対象から除外することはしない」としています3)。
日本での妊婦に対する適応は、2月7日現在審査を行っているところです。
- CDC. Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States
- WHO. The Moderna COVID-19 (mRNA-1273) vaccine: what you need to know
- 日本産婦人科感染症学会.COVID-19 ワクチン接種を考慮する妊婦さんならびに妊娠を希望する⽅へ
授乳中の女性にmRNAワクチンを接種しても大丈夫でしょうか?
授乳中の女性に対する十分なデータはまだありませんが、米国CDCは優先接種対象者にあたる授乳中の女性はmRNAワクチンの接種を考慮してよいとしています1)。
mRNAワクチンの成分は乳腺組織や母乳に移行するとは考えにくく、もし移行しても赤ちゃんに生物学的な影響を与える可能性は低いと考えられています2)。
- CDC. Vaccination Considerations for People who are Pregnant or Breastfeeding
- Academy of Breastfeeding Medicine. Considerations for COVID-19 vaccination in lactation. ABM Statement.
子供にも接種すべきでしょうか?
ファイザー・ビオンテック社ワクチンは16歳以上、モデルナ社ワクチンは18歳以上に対して臨床試験が行われました1,2)。
米国等の国ではそれと同じ年齢で承認がされており3)、日本国内での承認も同様の年齢層が対象になると考えられています。
現在ファイザー・ビオンテック社とモデルナ社による12歳以上の小児を対象とした治験が開始されています4,5)。
- N Engl J Med. 2020;383:2603-15
- N Engl J Med. 2021; 384:403-416
- CDC. COVID-19 Vaccines for Children, Advisory Committee on Immunization Practices (ACIP) January 27, 2021
- https://clinicaltrials.gov/ct2/show/NCT04649151
- https://clinicaltrials.gov/ct2/show/NCT04368728
新型コロナウイルスに感染した場合(既感染の場合)も接種が必要ですか?
無症候性の感染も含め、新型コロナウイルスに罹患された方(既感染者)にもワクチンの接種が推奨されます1)。
その理由は、再感染の可能性があることと、自然に感染するよりもワクチン接種の方が効果的な免疫を獲得出来る(高い抗体価が得られる)ことが分かっているからです。
なお、直前に感染した場合には感染から回復し、隔離の必要がなくなってからの接種が勧められています1)。
新型コロナウイルス回復期血漿療法やモノクローナル抗体治療を受けた方は、罹患後90日経過してからの接種が勧められています。
二回接種ではなく、一回接種だけで効果ありますか?
ファイザー・ビオンテック社ワクチンの一回目接種後(二回目接種直前)のワクチンの発症予防としての有効性は約50%でした1)。
確実に効果のある免疫を作るためには、二回の接種が必要です。
- N Engl J Med. 2020;383:2603-2615
一回目と二回目で違うmRNAワクチンを接種しても大丈夫ですか?
米国のCDCは、臨床試験に準じて同じワクチンを接種することを推奨しています1)。
ワクチン接種後に感染予防策は不要ですか?
mRNAワクチンではまだどの程度、無症状者も含めて感染を防ぐか、感染伝搬を防ぐかは研究中でありまだ結論が出ていません。
接種後も引き続きマスク、手洗い、ソーシャルディスタンシング等の基本的な感染予防策を続ける必要があります1)。
インフルエンザワクチンや帯状疱疹ワクチンなど、他の予防接種を新型コロナウイルスのワクチンの前後にうけても大丈夫ですか?
現時点では米国疾病対策予防センター(CDC)は、他のワクチンとの同時接種での安全性やワクチンの有効性に関する充分なデータがないので、原則的にはmRNAワクチン接種の前後14日以内はインフルエンザを含めた他のワクチンの接種は控えることを推奨しています1)。
しかしもし誤って間隔を空けずに打ってしまっても、接種しなおす必要はないとしています。
お金はかかりますか?
日本でも無料で接種が受けられるようになります1)。
- 厚生労働省 新型コロナワクチン接種についてのお知らせ
作成
こびナビ ワクチン説明チーム
こびナビ 池田早希
こびナビ 木下喬弘
千葉大学医学部附属病院 感染制御部 感染症内科 谷口俊文
テキサス州立大学ヒューストン校 感染症科 兒子真之
ベイラー医科大学/Baylor St. Luke‘s Medical Center 感染症科 福田由梨子
米国国立研究機関 峰宗太郎
ワシントンホスピタルセンター 内科 安川康介
Twitter @VaccineWatch